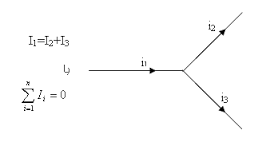
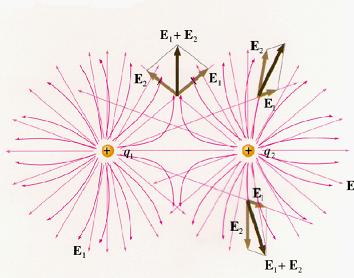
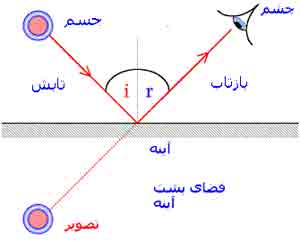
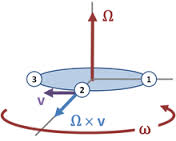
تبلیغات
آرشیو
نویسندگان
امکانات جانبی
 آمار
وب سایت:
آمار
وب سایت:
بازدید دیروز : 0
بازدید هفته : 21
بازدید ماه : 21
بازدید کل : 3283
تعداد مطالب : 19
تعداد نظرات : 0
تعداد آنلاین : 1
ورود کاربران
عضويت سريع
آمار
چت باکس
|
| |
| وب : | |
| پیام : | |
| 2+2=: | |
| (Refresh) | |
تبادل لینک
خبرنامه
براي اطلاع از آپيدت شدن سایت در خبرنامه سایت عضو شويد تا جديدترين مطالب به ايميل شما ارسال شود
آخرین نطرات

در این هنگام مدل اتمی كوانتمی (یا ابر الكترونی ) به همكاری بسیاری از دانشمندان به در عرصه رقابت مطرح شد . از جمله دانشمندانی كه در این مدل اتمی سهم چشمگیری داشتند ، هایزنبگ ، پلانك و شرودینگر را می توان نام برد . البته انیشتین با ارائه فرمول های خود نیز توانست به این مدل اتمی كمك كند . طبق این مدل اتمی اتم از هسته و الكترون تشكیل شده است ، كه هسته در مركز اتم قرار دارد و الكترون ها در اطراف هسته اتم در سطوح انرژی مشخصی حركت می كنند ( در اینجا باید توجه داشت كه همه الكترون ها به دور هسته نمی چرخند بلكه در اطراف آن در حال حركت هستند ) ، اما تعیین دقیق مكان (موضع ) و سرعت ( نوع حركت ) الكترون ها به طور هم زمان و در یك لحظه امكان پذیر نیست . الكترون ها در اطراف هسته اتم در فضای مشخصی حركت می كنند ، كه به این فضای اطراف اتم كه بیشترین احتمال وجود اتم را دارد ، اوربیتال می گویند . اوربیتال ها در واقع تراز انرژی الكترون ها را مشخص می كنند . هر كدام از این اوربیتال ها به چند زیر لایه تقسیم می شوند كه الكترون های زیر لایه های یك اوربیتال ، دارای انرژی یكسانی هستند . در مدل اتمی كوانتمی ، تجسم اتم بسیار مشكل است . به همین دلیل بعضی از افراد برای مطالعه دگرگونی های اتم در یك واكنش از مدل اتمی بور استفاده می كنند . البته مدل كوانتمی را در صفحه های سه بعدی (رایانه ) نشان می دهند . ورنر
هایزنبرگ ، دانشمند آلمانی ، خاطر نشان ساخت كه تعیین دقیق الكترون ( موضع ومكان آن ) و همچنین اندازه سرعت آن (نوع حركت ) در یك لحظه امكان پذیر نیست . برای دیدن جسمی وهمچنین تشخیص محل آن كافیست یك فوتون را به سطح آن گسیل كنیم و با انعكاس آن فوتون از سطح و بازگشتش به حسگر های مجازی یا حقیقی ( چشم یا هر نوع حسگر مجازی كه رادار ها را دریافت می كند ) ، موقعیت آن جسم را بازگو می كند . طبق قوانین پلانك در مورد امواج ، فوتون دارای طول موج و همچنین انرژی می باشد ، به همین دلیل هنگامی كه به سطح جسم برخورد می كند ، مقداری از انرژی خود را به سطح جسم مقابل منتقل می كند . اما ممكن است تاثیری بر آن نداشته باشد . ( مانند برخورد نور به سطح آینه وانعكاس آن ) اما اگر بخواهیم موقعیت یا جایگاه احتمالی الكترون ها را در اطراف هسته اتم بیابیم و یك فوتون به الكترون بتابانیم ، الكترون با دریافت مقداری انرژی از فوتون ، سرعتش افزایش می یابد ، و در نتیجه می توانیم از جایگاه و محل حركت الكترون مطلع شویم ، اما نمی توانیم از حركت و سرعت آن سخنی بگوییم و اگر با انجام آزمایش هایی (از جمله استفاده از میدان مغناطیسی ) بتوانیم سرعت الكترون را ثبت كنیم ، در اینجا نمی توانیم به طور دقیق محل حركت الكترون را مشخص كنیم . این بیان به عنوان عدم قطعیت هایزنبرگ شناخته شده است . پس ما در واقع اشكال اوربیتال ها را بر اساس امواجی كه از الكترون ها ساطع می شود ، مجسم می كنیم.
همانگونه که برای مشخص کردن موقعیت یک جسم در فضا به سه عدد (طول ، عرض و ارتفاع) نیاز است، برای مشخص کردن هر یک از اوربیتالهای یک اتم نیز به چنین داده هایی نیاز داریم. شرودینگر به این منظور از سه عدد M1 و L و n استفاده کرد که عددهای کوانتومی خوانده می شوند.
عدد کوانتومی اصلی (n) : عددی است که بور برای مشخص کردن ترازهای انرژی یا همان لایه های الکترونی بکار برد. ۱= n پایدارترین لایه انرزی را نشان می دهد. هر چه n بالاتر رود سطح انرژی لایه های الکترونی افزایش می یابد و فاصله ی آن لایه از هسته دورتر می شود. لایه های الکترونی خود از گروههای کوچک تر به نام زیر لایه تشکیل شده اند.عدد n تعداد زیر لایه های هر لایه را هم مشخص می کند. مثلاً در لایه الکترونی ۲= n دو زیر لایه وجود دارد.
عدد کوانتومی اوربیتالی (L) نشان دهنده ی شکل ، انرژی و تعداد اوربیتال ها است.
L می تواند مقادیر ۰ تا 1 - n را در بر بگیرد.
1 اوربیتال کردی L=0 ® S
اوربیتال دمبلی L=1 ® 3P
5 اوربیتال L=2 ® D
7 اوربیتال L=3 ® F
عدد کوانتومی مغناطیسی (۱m) :
جهت گیری اوربیتالها را در فضا معین می کند. ۱m می تواند مقادیری از L – تا L + دارا باشد. با در نظر گرفتن محورهای X ، y ، z قرار می گیرد و به صورت pX ؛ pY ؛ pZ نشان داده می شود. برای آدرس دادن اوربیتال ها به شیوه ی زیر عمل می شود:
برای مثال2px نشان می دهد که این اوربیتال دمبلی شکل در لایه های الکترونی دوم و در زیر لایه ی p قرار دارد و در راستای محور Xها جهت گیری کرده است.
عدد کوانتومی مغناطیسی اسپین (MS) : مربوط به جهت حرکت الکترون به دور خودش است. دانشمندان افزون بر حرکت اوربیتالی ، یک حرکت اسپینی نیز به الکترون نسبت داده اند (حرکت الکترون به دور خود MS تنها دو مقدار (½+ برای چرخش در جهت عقربه های ساعت و ½- برای چرخش در خلاف جهت حرکت عقربه های ساعت) دارد.
طبق اصل پائولی در هر اوربیتال حداکثر دو الکترون آن هم با اسپین مخالف قرار می گیرند.
اگر برای رسم آرایش الکترونی اتم عنصرهای دیگر از اتم هیدروژن شروع کنیم و سپس یک به یک بر تعداد پروتونهای درون هسته بیفزائیم، بدین گونه اتم عنصرهای سنگین تر از هیدروژن را به ترتیب افزایش عدد اتمی ساخته ایم. به این شیوه، اصل آفبا می گویند.
تاریخ ارسال پست: دو شنبه 25 اسفند 1398 ساعت: 1:21
تاریخ ارسال پست: دو شنبه 25 اسفند 1398 ساعت: 1:21